На кого больше похож крупноклеточный рак легкого?
#lung #pathway #article
Помню, еще в ординатуре меня поставили в тупик вопросом "- а крупноклеточный рак легкого по своей биологии похож на мелкую клетку или аденокарциному?"
Крупноклеточный рак легкого (ККРЛ), несмотря на то, что это отдельная (крайне редкая и неблагоприятная)нозология, может вести себя по - разному, в отдельных случаях обнаруживать черты "схожести" либо с мелкоклеточным раком, либо с НМРЛ (аденокарциномой).
"-Зачем нам это знать?", спросите вы. А затем, что больших исследований по лечению ККРЛ мы, скорее всего, никогда не увидим. И потому, в каждом случае, нам не остается ничего,кроме как экстраполировать и применять подходы лекарственного лечения на ККРЛ, принятых при других вариантах рака легкого.
Так какой же может быть "крупная клетка"? Если по сути и упрощенно:
SCLC-like: наличие сочетанных поломок генов Rb1 и p53 "роднят" ККРЛ с "мелкой клеткой". Указанные поломки часто сочетаются с амплификацией c- myc, которую уместно, на мой взгляд, окрестить "машиной канцерогенеза"
NSCLC - like: "дикий "статус гена Rb1 и наличие поломок, характерных для аденокарциномы. Сюда можно, конечно же, отнести поломку гена p53, а также KRAS и STK11.
Поводом для обсуждения "крупной клетки" сегодня стал обзор Laura Burns et al с результатами полногеномного секвенирования 1426 опухолевых образцов,взятых от пациентов с указанным заболеванием и это, судя по всему, крупнейшая работа по проблеме молекулярно - генетического ландшафта крупноклеточного рака легкого на сегодняшний день.
На одной из картинок представлена таблица с альтерациями, характерного для SCLC - like и NSCLC - like подтипов, которые, в целом, подтверждают ранее полученные результаты из более скромных работ целого ряда предшественников.
Но, есть ряд принципиально важных дополнений. Так, при NSCLC - like можно, как и в аденокарциноме, найти таргетируемые (либо потенциально таргетируемые) поломки (см. слайд)
#lung #pathway #article
Помню, еще в ординатуре меня поставили в тупик вопросом "- а крупноклеточный рак легкого по своей биологии похож на мелкую клетку или аденокарциному?"
Крупноклеточный рак легкого (ККРЛ), несмотря на то, что это отдельная (крайне редкая и неблагоприятная)нозология, может вести себя по - разному, в отдельных случаях обнаруживать черты "схожести" либо с мелкоклеточным раком, либо с НМРЛ (аденокарциномой).
"-Зачем нам это знать?", спросите вы. А затем, что больших исследований по лечению ККРЛ мы, скорее всего, никогда не увидим. И потому, в каждом случае, нам не остается ничего,кроме как экстраполировать и применять подходы лекарственного лечения на ККРЛ, принятых при других вариантах рака легкого.
Так какой же может быть "крупная клетка"? Если по сути и упрощенно:
SCLC-like: наличие сочетанных поломок генов Rb1 и p53 "роднят" ККРЛ с "мелкой клеткой". Указанные поломки часто сочетаются с амплификацией c- myc, которую уместно, на мой взгляд, окрестить "машиной канцерогенеза"
NSCLC - like: "дикий "статус гена Rb1 и наличие поломок, характерных для аденокарциномы. Сюда можно, конечно же, отнести поломку гена p53, а также KRAS и STK11.
Поводом для обсуждения "крупной клетки" сегодня стал обзор Laura Burns et al с результатами полногеномного секвенирования 1426 опухолевых образцов,взятых от пациентов с указанным заболеванием и это, судя по всему, крупнейшая работа по проблеме молекулярно - генетического ландшафта крупноклеточного рака легкого на сегодняшний день.
На одной из картинок представлена таблица с альтерациями, характерного для SCLC - like и NSCLC - like подтипов, которые, в целом, подтверждают ранее полученные результаты из более скромных работ целого ряда предшественников.
Но, есть ряд принципиально важных дополнений. Так, при NSCLC - like можно, как и в аденокарциноме, найти таргетируемые (либо потенциально таргетируемые) поломки (см. слайд)
❤26👍2🤔1
Не каждое изменение в ДНК приводит к раку и развязывает руки для таргетной терапии
#forpatients #pathway #article
Воскресенье - вечер лайтовых постов. Лайтовых для написания, по крайней мере
Наткнулся я тут на любопытный обзор, посвященный интерпретации результатов генетических тестов в реальной практике. Весь обзор пересказывать не стану, но поделюсь парой ключевых мыслей по данному вопросу.
— Далеко не любая поломка в ДНК приводит к ЗНО и вообще хоть сколь нибудь биологически значима. В опухолевых клетках может быть хоть лям мутаций, но лишь пара - десятков из них действительно "вмешиваются в игру" и определяют путь биологического развития конкретной опухолины. И, к сожалению, среди них может не быть ни одной поломки, служащей для нас поводом подумать о таргетной терапии, тем более о каком - нибудь off-label. Не во всех случаях ЗНО можно выделить драйверные мутации (особенно мало их в саркомах).
— Бывает так, что мы находим какую - нибудь EGFR - мутацию в случае, когда у нас не рак легкого(ну прям точно нет). И сразу возникает соблазн подумать об анти - EGFR - терапии. Однако," surprise - surprise " в том, что одна и та же поломка может выступать драйвером и отличной мишенью для терапии в одних случаях (НМРЛ)...и совершенно не иметь никакой клинической ценности в другом. Вспомнить хотя бы, как безбожно облажались EGFR - ингибиторы в глиомах; насколько неоднозначна роль EGFR - ингибиторов при раке головы и шеи...
— А бывают и вовсе дурацкие ситуации. Находят что - то редкое, но таргетируемое - например, альтерацию NTRK. Только вот получить соответствующие ингибиторы - тот еще квест. Но, кажется, я повторяюсь.
С большими возможностями молекулярной диагностики лично у меня сопряжены и большие разочарования. Но не все так плохо - просто важно делать то что нужно именно тогда, когда это действительно нужно.
На моей короткой памяти NGS у пациента с метастатическим предлеченным ЗНО еще ни разу не дало ничего, кроме финансовых расходов. Может быть коллеги поделятся удачным опытом?
#forpatients #pathway #article
Воскресенье - вечер лайтовых постов. Лайтовых для написания, по крайней мере
Наткнулся я тут на любопытный обзор, посвященный интерпретации результатов генетических тестов в реальной практике. Весь обзор пересказывать не стану, но поделюсь парой ключевых мыслей по данному вопросу.
— Далеко не любая поломка в ДНК приводит к ЗНО и вообще хоть сколь нибудь биологически значима. В опухолевых клетках может быть хоть лям мутаций, но лишь пара - десятков из них действительно "вмешиваются в игру" и определяют путь биологического развития конкретной опухолины. И, к сожалению, среди них может не быть ни одной поломки, служащей для нас поводом подумать о таргетной терапии, тем более о каком - нибудь off-label. Не во всех случаях ЗНО можно выделить драйверные мутации (особенно мало их в саркомах).
— Бывает так, что мы находим какую - нибудь EGFR - мутацию в случае, когда у нас не рак легкого(ну прям точно нет). И сразу возникает соблазн подумать об анти - EGFR - терапии. Однако," surprise - surprise " в том, что одна и та же поломка может выступать драйвером и отличной мишенью для терапии в одних случаях (НМРЛ)...и совершенно не иметь никакой клинической ценности в другом. Вспомнить хотя бы, как безбожно облажались EGFR - ингибиторы в глиомах; насколько неоднозначна роль EGFR - ингибиторов при раке головы и шеи...
— А бывают и вовсе дурацкие ситуации. Находят что - то редкое, но таргетируемое - например, альтерацию NTRK. Только вот получить соответствующие ингибиторы - тот еще квест. Но, кажется, я повторяюсь.
С большими возможностями молекулярной диагностики лично у меня сопряжены и большие разочарования. Но не все так плохо - просто важно делать то что нужно именно тогда, когда это действительно нужно.
На моей короткой памяти NGS у пациента с метастатическим предлеченным ЗНО еще ни разу не дало ничего, кроме финансовых расходов. Может быть коллеги поделятся удачным опытом?
👍17❤6🤔3
Осмысление ключевых признаков опухолевой клетки, часть черт знает какая: каким образом ключевые признаки опухолевой клетки взаимно обусловливают и дополняют друг друга в злокачественных новообразованиях
#pathway #hallmarks
Опираясь на свой скромный преподавательский опыт, я могу утверждать, что обсуждение тем, касающихся биологии опухолевой клетки и, в особенности, ключевых признаков опухолевой клетке, дается непросто. Если говорить прямо, то многим ребятам не всегда очевидно, на кой черт вообще следует их обсуждать и как понимание ключевых признаков вяжется с нашей рутинной работой. И я их понимаю.
По правде говоря, вы можете выполнять свои рабочие и профессиональные обязанности, и делать это весьма успешно, и без понимания тонких молекулярных материй.
По себе могу сказать, что работа с пациентом оказывается куда интереснее, когда за историями болезни, рутинными случаями и линиями терапии, безбожно сменяющими одна другую, ты представляешь, каким именно образом развивается и течет заболевание конкретного пациента и почему ты видишь тот или иной эффект противоопухолевой терапии.
По этой причине я решил попробовать уложить в своей голове и продемонстрировать свое видение (ну, основанное на изучении существующих данных, естественно) того, как именно ключевые признаки опухолевой клетки способствуют канцерогенезу.
По ссылке вы найдете размышления о том, каким образом одни ключевые признаки становятся основой для появления других признаков, как они вообще взаимосвязаны друг с другом и как именно они определяют течение опухолевого заболевания - ровно в той степени, насколько это вписывается в нашу рутинную практику.
https://telegra.ph/Dlya-samyh-novenkih-kak-klyuchevye-priznaki-opuholevoj-kletki-uzhivayutsya-i-vzaimodejstvuyut-mezhdu-soboj-01-21
#pathway #hallmarks
Опираясь на свой скромный преподавательский опыт, я могу утверждать, что обсуждение тем, касающихся биологии опухолевой клетки и, в особенности, ключевых признаков опухолевой клетке, дается непросто. Если говорить прямо, то многим ребятам не всегда очевидно, на кой черт вообще следует их обсуждать и как понимание ключевых признаков вяжется с нашей рутинной работой. И я их понимаю.
По правде говоря, вы можете выполнять свои рабочие и профессиональные обязанности, и делать это весьма успешно, и без понимания тонких молекулярных материй.
По себе могу сказать, что работа с пациентом оказывается куда интереснее, когда за историями болезни, рутинными случаями и линиями терапии, безбожно сменяющими одна другую, ты представляешь, каким именно образом развивается и течет заболевание конкретного пациента и почему ты видишь тот или иной эффект противоопухолевой терапии.
По этой причине я решил попробовать уложить в своей голове и продемонстрировать свое видение (ну, основанное на изучении существующих данных, естественно) того, как именно ключевые признаки опухолевой клетки способствуют канцерогенезу.
По ссылке вы найдете размышления о том, каким образом одни ключевые признаки становятся основой для появления других признаков, как они вообще взаимосвязаны друг с другом и как именно они определяют течение опухолевого заболевания - ровно в той степени, насколько это вписывается в нашу рутинную практику.
https://telegra.ph/Dlya-samyh-novenkih-kak-klyuchevye-priznaki-opuholevoj-kletki-uzhivayutsya-i-vzaimodejstvuyut-mezhdu-soboj-01-21
Telegraph
Для самых новеньких: как ключевые признаки опухолевой клетки “уживаются” и “взаимодействуют” между собой.
Сразу скажу, что материал ориентирован преимущественно на тех, кто только - только начинает постижение данной темы, и особенно на тех, кто вообще не рубит ничего в молекулярной онкологии и онкологии в целом. Я стремился максимально упростить повествование…
❤50👏6🔥4👍3
Поданализ Impower 133 и подтипы МРЛ: выигрывают все, но кто - то чуть больше
#lung #news #pathway
Роль атезолизумаба в лечении метастатического мелкоклеточного рака легкого (МРЛ), на мой взгляд, неоднозначная. Формально мы имеем успешное исследование Impower133, где прослеживается бенефит в общей выживаемости в два месяца (период между обследованиями).
Какие вопросы у меня к Impower 133, я рассказывал тут.На моей памяти, ни одного человека с метастатическим МРЛ, который не прогрессировал бы в скором времени после перехода на поддерживающий режим терапии атезолизумабом. Есть, правда, одна пациентка, которая получает атезолизумаб уже года полтора, не прогрессирует и кайфует от жизни - но там исходно cT4N2M0, т.е. это исходно прогностически более благоприятная история, чем М1.
Но это, естественно, просто наблюдения, которые могут не иметь ничего общего с реальностью. И я,естественно, применяю атезолизумаб с ЕР, так как, наряду с дурвалумабом, это пока лучшее, что можно предложить пациентам в первой линии терапии.
Можно было бы, как я люблю, просто покрыть херами конкретную опцию и сказать "исследователи дураки, атезо не работает". А можно подумать, почему мы далеко не всегда видим воодушевляющие результаты лечения при МРЛ. И тут я бы снова сделал отсылку к молекулярно - генетической гетерогенности МРЛ, природа которой только - только проясняется.
Нашему вниманию недавно был представлен поданализ Impower 133, в рамках которого оценивался эффект атезолизумаба. Как видим, выраженность положительного влияния атезолизумаба на общую выживаемость оказывается наибольшей для SCLC - I подтипа (он может фигурировать под названием SCLC - Y/ YAP1- подтипа) - см тут.
Анализ важный - это очередной шаг к формированию новых гипотез и дизайна для будущих исследований; потенциальное объяснение того, почему одни живут на иммунотерапии дольше, чем другие и прогрессируют позже. Хотя, ловлю себя на мысли, что в отношении МРЛ нам очень не хватает принципиально новых подходов к терапии.
#lung #news #pathway
Роль атезолизумаба в лечении метастатического мелкоклеточного рака легкого (МРЛ), на мой взгляд, неоднозначная. Формально мы имеем успешное исследование Impower133, где прослеживается бенефит в общей выживаемости в два месяца (период между обследованиями).
Какие вопросы у меня к Impower 133, я рассказывал тут.На моей памяти, ни одного человека с метастатическим МРЛ, который не прогрессировал бы в скором времени после перехода на поддерживающий режим терапии атезолизумабом. Есть, правда, одна пациентка, которая получает атезолизумаб уже года полтора, не прогрессирует и кайфует от жизни - но там исходно cT4N2M0, т.е. это исходно прогностически более благоприятная история, чем М1.
Но это, естественно, просто наблюдения, которые могут не иметь ничего общего с реальностью. И я,естественно, применяю атезолизумаб с ЕР, так как, наряду с дурвалумабом, это пока лучшее, что можно предложить пациентам в первой линии терапии.
Можно было бы, как я люблю, просто покрыть херами конкретную опцию и сказать "исследователи дураки, атезо не работает". А можно подумать, почему мы далеко не всегда видим воодушевляющие результаты лечения при МРЛ. И тут я бы снова сделал отсылку к молекулярно - генетической гетерогенности МРЛ, природа которой только - только проясняется.
Нашему вниманию недавно был представлен поданализ Impower 133, в рамках которого оценивался эффект атезолизумаба. Как видим, выраженность положительного влияния атезолизумаба на общую выживаемость оказывается наибольшей для SCLC - I подтипа (он может фигурировать под названием SCLC - Y/ YAP1- подтипа) - см тут.
Анализ важный - это очередной шаг к формированию новых гипотез и дизайна для будущих исследований; потенциальное объяснение того, почему одни живут на иммунотерапии дольше, чем другие и прогрессируют позже. Хотя, ловлю себя на мысли, что в отношении МРЛ нам очень не хватает принципиально новых подходов к терапии.
❤21👍11🔥2
Чем могут различаться между собой люминальные раки молочной железы? Чуть - чуть больше новых данных
#breast #pathway
Так уж получилось, что я весьма глубоко погружен в тему лечения метастатического рака молочной железы. И я не могу не отметить существование ряда противоречивых и интересных вопросов в рамках данной проблемы.
Например, люминальные раки могут вести себя по - разному, что проявляется в разных сроках прогрессирования после начала адъювантной гормонотерапии, которые мы наблюдаем у пациенток. Одни не прогрессируют долго, другие прогрессируют в первые два года, третьи - чуть более отсроченно. Одни сидят на CDK4/6 и ингибиторах ароматазы/фулвестрантом годами, другие - прогрессируют через пару месяцев от начала терапии.
Природа подобных различий продолжает активно изучаться, то и дело появляются весьма сносные работы. Об одной из них работе, опубликованной недавно Nayan Chaudhary et al , - по ссылке
#breast #pathway
Так уж получилось, что я весьма глубоко погружен в тему лечения метастатического рака молочной железы. И я не могу не отметить существование ряда противоречивых и интересных вопросов в рамках данной проблемы.
Например, люминальные раки могут вести себя по - разному, что проявляется в разных сроках прогрессирования после начала адъювантной гормонотерапии, которые мы наблюдаем у пациенток. Одни не прогрессируют долго, другие прогрессируют в первые два года, третьи - чуть более отсроченно. Одни сидят на CDK4/6 и ингибиторах ароматазы/фулвестрантом годами, другие - прогрессируют через пару месяцев от начала терапии.
Природа подобных различий продолжает активно изучаться, то и дело появляются весьма сносные работы. Об одной из них работе, опубликованной недавно Nayan Chaudhary et al , - по ссылке
Nature
CDK4/6i-treated HR+/HER2- breast cancer tumors show higher ESR1 mutation prevalence and more altered genomic landscape
npj Breast Cancer - CDK4/6i-treated HR+/HER2- breast cancer tumors show higher ESR1 mutation prevalence and more altered genomic landscape
❤33👍5
Не все молекулярные поломки предиктивно одинаковые: новые данные об FGFR - ингибиторах за пределами уротелиальной карциномы
#news #pathway
Давным - давно мы с вами обсуждали, что характер поломок гена, кодирующих конкретную тирозинкиназу, детерминирует эффективность соответствующих тирозинкиназных ингибиторов. Помнится, мы сошлись на том, что в случае амплификации гена - когда увеличивается количество его копий в ДНК - мы видим наименьшую активность таргетной терапии.
Как влияет характер поломки гена на эффективность - вопрос совершенно не праздный, особенно тогда, когда у части пациентов (ну ладно, у очень ограниченного количества пациентов) есть возможность бахнуть себе NGS и поискать в опухоли что - то интересное.
В фокусе сегодняшнего внимания - амплификация генов FGFR. Jun Gon со своей командой взялся провести исследование второй фазы по изучению эрдафитиниба. Вы могли слышать про этот препарат в контексте поздних линий лечения распространенного уротелиального рака с поломками FGFR3, который опрокинул химиотерапию в исследовании THOR. Как это неоднократно случалось, если препарат сработал в отношении конкретной поломки в одной нозологии, его пробуют где - то еще.
Так и вышло с исследованием EAY131-K1 - мультикогортным исследованием 2 фазы, где эрдафитиниб примеряют к разным солидным и гематологическим неоплазмам, которым посчастливилось заиметь у себя амплификацию генов FGFR (1-4). На днях были представлены результаты лечения когорты пациентов с солидными опухолями. Из очевидных соображений, пациенты с уротелиальной карциномой в это исследование не включались - что привело к нулевой частоте объективного ответа, медиане без прогрессирования в 1.7 месяцев (чисто на период между обследованиями) и очень скромной общей выживаемости - mOS = 4.2. месяца
Какие мысли есть на этот счет:
- из очевидного и практического: если вы нашли в заключении NGS амплификацию FGFR и вы не имеете дело с уротелиальной карциномой - не стоит во что бы то ни стало искать эрдафитиниб
- из неочевидного - в упомянутом THOR я не нашел данных о том, что среди включенных пациентов с уротелиальной карциномой был кто - то с амплификацией. Стоит ли пробовать эрдафитиниб при наличии амплификации FGFR (амплификации FGFR встречается до 7% случаев рака мочевого пузыря) - для меня, собственно, пока тоже вопрос.
- пока что каждая встреча с данными по FGFR - ингибиторам наводит меня на мысль о скромном терапевтическом потенциале этой мишени где - бы то ни было, кроме как в уротелиальной карциноме
Upd.и,возможно,в холангиокарциноме
p.s. если вы забыли, кто такой этот ваш FGFR - вам сюда
#news #pathway
Давным - давно мы с вами обсуждали, что характер поломок гена, кодирующих конкретную тирозинкиназу, детерминирует эффективность соответствующих тирозинкиназных ингибиторов. Помнится, мы сошлись на том, что в случае амплификации гена - когда увеличивается количество его копий в ДНК - мы видим наименьшую активность таргетной терапии.
Как влияет характер поломки гена на эффективность - вопрос совершенно не праздный, особенно тогда, когда у части пациентов (ну ладно, у очень ограниченного количества пациентов) есть возможность бахнуть себе NGS и поискать в опухоли что - то интересное.
В фокусе сегодняшнего внимания - амплификация генов FGFR. Jun Gon со своей командой взялся провести исследование второй фазы по изучению эрдафитиниба. Вы могли слышать про этот препарат в контексте поздних линий лечения распространенного уротелиального рака с поломками FGFR3, который опрокинул химиотерапию в исследовании THOR. Как это неоднократно случалось, если препарат сработал в отношении конкретной поломки в одной нозологии, его пробуют где - то еще.
Так и вышло с исследованием EAY131-K1 - мультикогортным исследованием 2 фазы, где эрдафитиниб примеряют к разным солидным и гематологическим неоплазмам, которым посчастливилось заиметь у себя амплификацию генов FGFR (1-4). На днях были представлены результаты лечения когорты пациентов с солидными опухолями. Из очевидных соображений, пациенты с уротелиальной карциномой в это исследование не включались - что привело к нулевой частоте объективного ответа, медиане без прогрессирования в 1.7 месяцев (чисто на период между обследованиями) и очень скромной общей выживаемости - mOS = 4.2. месяца
Какие мысли есть на этот счет:
- из очевидного и практического: если вы нашли в заключении NGS амплификацию FGFR и вы не имеете дело с уротелиальной карциномой - не стоит во что бы то ни стало искать эрдафитиниб
- из неочевидного - в упомянутом THOR я не нашел данных о том, что среди включенных пациентов с уротелиальной карциномой был кто - то с амплификацией. Стоит ли пробовать эрдафитиниб при наличии амплификации FGFR (амплификации FGFR встречается до 7% случаев рака мочевого пузыря) - для меня, собственно, пока тоже вопрос.
- пока что каждая встреча с данными по FGFR - ингибиторам наводит меня на мысль о скромном терапевтическом потенциале этой мишени где - бы то ни было, кроме как в уротелиальной карциноме
Upd.и,возможно,в холангиокарциноме
p.s. если вы забыли, кто такой этот ваш FGFR - вам сюда
Telegram
Очерки фундаментальной онкологии
"Молекулярный портрет" рецепторной тирозинкиназы и эффективность тирозинкиназных ингибиторов
#news #theapy
Я не особо задумывался о том, влияет ли характер нарушений структуры гена рецепторных тирозинкиназ (РТК) на эффективность мультикиназных ингибиторов…
#news #theapy
Я не особо задумывался о том, влияет ли характер нарушений структуры гена рецепторных тирозинкиназ (РТК) на эффективность мультикиназных ингибиторов…
👍7❤6🔥4
Почему разные опухоли обладают неодинаковым риском ВТЭО, часть 1; тканевой фактор и драйверные поломки
#support #pathway
Сегодня у нас очередная попытка найти простые ответы на сложные вопросы. Известно, что ЗНО - один из факторов риска развития венозной тромбоэмболии, я думаю, что моя аудитория не нуждается в разъяснении, откуда мы это знаем, но если вы подзабыли - вот вам отсылки на старые посты по этой теме:
Канцер – ассоциированные тромбозы и новые данные о сравнительной эффективности и безопасности антикоагулянтов – Telegraph
Профилактика и лечение тромбозов у онкологических пациентов: апдейт рекомендаций ESMO 2023 – Telegraph
Однако, вам наверняка известно, что разные варианты ЗНО обладают немного разным риском развития указанного осложнения. И что наиболее высокий риск и частота ВТЭО прослеживается при раке поджелудочной железы, желудка, легких и первичных ЗНО центральной нервной системы.
Что же в них такого особенного? Почему именно при указанных нозологиях мы сталкиваемся с проблемой ВТЭО наиболее часто? Есть ли тут привязка к их молекулярно - генетическому ландшафту? Попробуем разобраться.
https://telegra.ph/Tkanevoj-faktor-i-drajvernye-polomki-v-kontekste-riska-kancer---associirovannogo-tromboza-04-25
#support #pathway
Сегодня у нас очередная попытка найти простые ответы на сложные вопросы. Известно, что ЗНО - один из факторов риска развития венозной тромбоэмболии, я думаю, что моя аудитория не нуждается в разъяснении, откуда мы это знаем, но если вы подзабыли - вот вам отсылки на старые посты по этой теме:
Канцер – ассоциированные тромбозы и новые данные о сравнительной эффективности и безопасности антикоагулянтов – Telegraph
Профилактика и лечение тромбозов у онкологических пациентов: апдейт рекомендаций ESMO 2023 – Telegraph
Однако, вам наверняка известно, что разные варианты ЗНО обладают немного разным риском развития указанного осложнения. И что наиболее высокий риск и частота ВТЭО прослеживается при раке поджелудочной железы, желудка, легких и первичных ЗНО центральной нервной системы.
Что же в них такого особенного? Почему именно при указанных нозологиях мы сталкиваемся с проблемой ВТЭО наиболее часто? Есть ли тут привязка к их молекулярно - генетическому ландшафту? Попробуем разобраться.
https://telegra.ph/Tkanevoj-faktor-i-drajvernye-polomki-v-kontekste-riska-kancer---associirovannogo-tromboza-04-25
Telegraph
Тканевой фактор и драйверные поломки в контексте риска канцер - ассоциированного тромбоза
Пара слов о патогенезе ВТЭО (да, еще раз). Освежать в памяти патофизиологию редко бывает излишним, поэтому мы сделаем это снова. Если суммировать множество литературных данных по вопросу патогенеза канцер - ассоциированных тромбозов (далее КАТ), то в нем…
❤35👍3
#forpatients #pathway
Однако, есть биохимические нюансы, о которых пациенты могут (и имеют право) быть не в курсе.
— Нуклеиновые кислоты, попадая в организм с пищей (либо с препаратами из нашего кейса) подвергаются расщеплению ферментами поджелудочной железы (рибонуклеазами и КО) на маленькие "кирпичики" - нуклеотиды.
Те, в свою очередь, поступают в клетки кишечника, в стремлении стать частью чего - то большего - например, ДНК в лейкоцитах - в составе которой они могли бы защищать организм от бушующих бактерий.
Однако, в кишечнике экзогенные нуклеотиды встречает ксантиноксидаза. Та, будучи неподкупаемым таможенником, не пропускает нуклеотиды в том виде, в котором они к ней пришли и превращает их в мочевую кислоту. Та уже благополучно выводится с мочой либо с калом. Такая вот миграционная политика в кишечнике
— это означает, что внешних источников нуклеотидов для синтеза ДНК не существует. Точнее, они есть, но это не экзогенные нуклеиновые кислоты.
Субстратом для синтеза нуклеиновых кислот (читай -ДНК/РНК)в организме служат:
- глюкоза (та самая, что по версии некоторых аутистов "кормит рак и способствует его прогрессированию" - через пентозо -фосфатный цикл, превращаясь в пятиуглеводный сахар - рибозу
- аминокислоты, служащие субстратом для синтеза азотистых оснований (гуанин, аденин, урацил, тимин, цитозин)
- остатки фосфорной кислоты
Исходя из этого, полноценное питание с соблюдением суточной нормы БЖУ даст вам куда больше пользы между циклами химиотерапии, чем применение всякой шняги, еще и стоящей весьма приличной суммы денег.
По крайней мере, у нас есть данные, что проблемы с питанием могут усугублять риск развития осложнений химиотерапии.
Однако, есть биохимические нюансы, о которых пациенты могут (и имеют право) быть не в курсе.
— Нуклеиновые кислоты, попадая в организм с пищей (либо с препаратами из нашего кейса) подвергаются расщеплению ферментами поджелудочной железы (рибонуклеазами и КО) на маленькие "кирпичики" - нуклеотиды.
Те, в свою очередь, поступают в клетки кишечника, в стремлении стать частью чего - то большего - например, ДНК в лейкоцитах - в составе которой они могли бы защищать организм от бушующих бактерий.
Однако, в кишечнике экзогенные нуклеотиды встречает ксантиноксидаза. Та, будучи неподкупаемым таможенником, не пропускает нуклеотиды в том виде, в котором они к ней пришли и превращает их в мочевую кислоту. Та уже благополучно выводится с мочой либо с калом. Такая вот миграционная политика в кишечнике
— это означает, что внешних источников нуклеотидов для синтеза ДНК не существует. Точнее, они есть, но это не экзогенные нуклеиновые кислоты.
Субстратом для синтеза нуклеиновых кислот (читай -ДНК/РНК)в организме служат:
- глюкоза (та самая, что по версии некоторых аутистов "кормит рак и способствует его прогрессированию" - через пентозо -фосфатный цикл, превращаясь в пятиуглеводный сахар - рибозу
- аминокислоты, служащие субстратом для синтеза азотистых оснований (гуанин, аденин, урацил, тимин, цитозин)
- остатки фосфорной кислоты
Исходя из этого, полноценное питание с соблюдением суточной нормы БЖУ даст вам куда больше пользы между циклами химиотерапии, чем применение всякой шняги, еще и стоящей весьма приличной суммы денег.
По крайней мере, у нас есть данные, что проблемы с питанием могут усугублять риск развития осложнений химиотерапии.
👍42❤7🔥6😁4
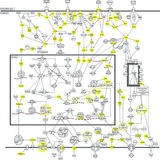
Схемки для задротов и не только
#pathway
Потея над очередным лонгридом, наткнулся на вот такую вот подробную схему. Здесь представлен ряд важных, я бы даже сказал центральных сигнальных каскадов, реализующих себя в патогенезе различных злокачественных новообразований. Нашел неожиданно, ссылка тут. Каких - то грубых ошибок в схеме не нашел, но если не согласны с чем - то - пишите в комментариях
"- Что в этой схеме интересного", спросите вы. "Схема как схема, опять какие - то наборы букв, стрелки в разные стороны, автор ты чего вообще, как в этом разобраться?"
Разобравшись в этой схеме (позалипав в нее и вернувшись к ней несколько раз), сложные видоописания молекулярщины, которыми изобилуют отдельные посты на данном канале, будут пугать вас чуть меньше.
Какой бы вычурной не была отдельная нозология, взаимоотношения между перечисленными участниками сигнальных каскадов плюс - минус стереотипные и повторяющие от опухоли к опухоли. Безусловно, многое в биологии опухоли решают конкретные особенности молекулярного и эпигенетического ландшафта и то, как они "взаимодействуют" между собой в рамках отдельной опухоли - но сами сигнальные каскады, в общем - то, составлены из одинаковых участников и приводят к реализации закономерных и стереотипных внутриклеточных эффектов.
Наиболее утонченные и повернутые на сигнальных каскадах люди, к слову, отметят, что указаны и нарисованы далеко не все "мостики" между сигнальными каскадами. На мой взгляд, такие тонкости нужны лишь ограниченному количеству людей, но мы все равно будем обсуждать то, что осталось за кадром схемы, еще много -много раз. Некоторые из них - в весьма скором времени.
#pathway
Потея над очередным лонгридом, наткнулся на вот такую вот подробную схему. Здесь представлен ряд важных, я бы даже сказал центральных сигнальных каскадов, реализующих себя в патогенезе различных злокачественных новообразований. Нашел неожиданно, ссылка тут. Каких - то грубых ошибок в схеме не нашел, но если не согласны с чем - то - пишите в комментариях
"- Что в этой схеме интересного", спросите вы. "Схема как схема, опять какие - то наборы букв, стрелки в разные стороны, автор ты чего вообще, как в этом разобраться?"
Разобравшись в этой схеме (позалипав в нее и вернувшись к ней несколько раз), сложные видоописания молекулярщины, которыми изобилуют отдельные посты на данном канале, будут пугать вас чуть меньше.
Какой бы вычурной не была отдельная нозология, взаимоотношения между перечисленными участниками сигнальных каскадов плюс - минус стереотипные и повторяющие от опухоли к опухоли. Безусловно, многое в биологии опухоли решают конкретные особенности молекулярного и эпигенетического ландшафта и то, как они "взаимодействуют" между собой в рамках отдельной опухоли - но сами сигнальные каскады, в общем - то, составлены из одинаковых участников и приводят к реализации закономерных и стереотипных внутриклеточных эффектов.
Наиболее утонченные и повернутые на сигнальных каскадах люди, к слову, отметят, что указаны и нарисованы далеко не все "мостики" между сигнальными каскадами. На мой взгляд, такие тонкости нужны лишь ограниченному количеству людей, но мы все равно будем обсуждать то, что осталось за кадром схемы, еще много -много раз. Некоторые из них - в весьма скором времени.
👍28🔥15👏2
Почему мы еще не победили рак поджелудочной железы: что там с ней не так
#pancreatic #pathway
Не так то просто будет представить себе более сложную локализацию для иммунотерапии и таргетной терапии нозологию, как рак поджелудочной железы. Да и химиотерапия данного заболевания - далеко не самая простая и приятная задача.
Рак поджелудочной железы печально известен своим агрессивным течением, не воодушевляющей многих онкологов частотой ответа на химиотерапию, отсутствием мишеней для рутинного применения таргетной терапии, отсутствием предпоссылок для эффекта чек- поинт ингибиторов…и чрезвычайно скромной пятилетней выживаемостью на всех стадиях данного заболевания.
Что лежит в основе столь агрессивного течения и терапевтических неудач? Об этом, а также о нюансах биологии аденокарциномы поджелудочной железы (в общих и базовых чертах) - по ссылке:
https://telegra.ph/CHto-ty-takoe-Osnovnye-momenty-v-biologii-adenokarcinomy-podzheludochnoj-zhelezy-05-20
#pancreatic #pathway
Не так то просто будет представить себе более сложную локализацию для иммунотерапии и таргетной терапии нозологию, как рак поджелудочной железы. Да и химиотерапия данного заболевания - далеко не самая простая и приятная задача.
Рак поджелудочной железы печально известен своим агрессивным течением, не воодушевляющей многих онкологов частотой ответа на химиотерапию, отсутствием мишеней для рутинного применения таргетной терапии, отсутствием предпоссылок для эффекта чек- поинт ингибиторов…и чрезвычайно скромной пятилетней выживаемостью на всех стадиях данного заболевания.
Что лежит в основе столь агрессивного течения и терапевтических неудач? Об этом, а также о нюансах биологии аденокарциномы поджелудочной железы (в общих и базовых чертах) - по ссылке:
https://telegra.ph/CHto-ty-takoe-Osnovnye-momenty-v-biologii-adenokarcinomy-podzheludochnoj-zhelezy-05-20
Telegraph
Что ты такое? Основные моменты в биологии аденокарциномы поджелудочной железы
Преамбула. Если вам показалось, что я излишне нагнетаю, говоря о суровости рака поджелудочной железы, то я лишь хочу показать эпидемиологические данные, собранные к 2019 году, согласно которым показатели смертности от рака поджелудочной железы…лишь немногим…
❤50👍17
Почему рак почки может по - разному ответить на лекарственное лечение? Терапевтически значимые эпигенетические различия саркоматоидного и эпителиоидного рака почки
#renal #news #pathway
Мы с вами знаем, что карцинома почки с саркоматоидным компонентам, судя по всему, лучше отвечает на терапию чек - поинт ингибиторами и хуже - на терапию с применением тирозинкиназных ингибиторов (ТКИ). Задумывались ли вы когда - нибудь почему?
Я тоже нет, пока на глаза не попалась свежая работа от Talal El Zarif et al, проливающая свет на то, как эпигенетические нарушения могут определять эффект того или иного режима терапии. И их результаты, если не объясняют такие различия полностью, то позволяют хоть чтуь - чуть приблизиться к пониманию их природы.
На основании анализа эпигенетического ландшафта (избавьте меня от технической части, я сам в ней плаваю) опухолевого материала, отобранных у 50 пациентов с почечно - клеточным раком (участвовавших в исследованиях Javelin RENAL 101, IMmotion 151), чья опухоль у 15 человек (30%) характеризовалась наличием саркоматоидного компонента. Исследователи искали стереотипные, повторяющиеся паттерны эпигенетических нарушений…и нашли кое - что любопытное.
https://telegra.ph/Nemnogo-molekulyarnogo-zadrotstva-FOSL1-i-rak-pochki-s-sarkomatoidnym-komponentom-06-13
#renal #news #pathway
Мы с вами знаем, что карцинома почки с саркоматоидным компонентам, судя по всему, лучше отвечает на терапию чек - поинт ингибиторами и хуже - на терапию с применением тирозинкиназных ингибиторов (ТКИ). Задумывались ли вы когда - нибудь почему?
Я тоже нет, пока на глаза не попалась свежая работа от Talal El Zarif et al, проливающая свет на то, как эпигенетические нарушения могут определять эффект того или иного режима терапии. И их результаты, если не объясняют такие различия полностью, то позволяют хоть чтуь - чуть приблизиться к пониманию их природы.
На основании анализа эпигенетического ландшафта (избавьте меня от технической части, я сам в ней плаваю) опухолевого материала, отобранных у 50 пациентов с почечно - клеточным раком (участвовавших в исследованиях Javelin RENAL 101, IMmotion 151), чья опухоль у 15 человек (30%) характеризовалась наличием саркоматоидного компонента. Исследователи искали стереотипные, повторяющиеся паттерны эпигенетических нарушений…и нашли кое - что любопытное.
https://telegra.ph/Nemnogo-molekulyarnogo-zadrotstva-FOSL1-i-rak-pochki-s-sarkomatoidnym-komponentom-06-13
Telegraph
Немного молекулярного задротства: FOSL1 и рак почки с саркоматоидным компонентом
___________________________________ Ну, для начала освежим в памяти работы, которые свидетельствуют в пользу того, что иммунотерапия чек- поинт ингибиторами - предпочтительная опция для рака почки с саркоматоидным компонентом. Данные, честно говоря, скромные…
❤18👍6🔥4
Почему и как погибают онкологические пациенты, часть 1
#pathway #case
На первый взгляд, это невероятно простой вопрос, который не требует какого - либо ответа или пояснения.“Что тут вообще обсуждать??Есть рак, есть метастазы, чего ж вы ждете и хотите? Исход предрешен”, скажет еще кто - то, мол “все и так понятно”. Ну завидую гениям, кому все ясно в вопросах танатогенеза онкопациентов. Мне же не понятно еще очень многое.
Если углубиться в вопрос, как сделали Adrienne Boire и его коллеги, то можно разглядеть с десяток механизмов гибели наших пациентов с метастатическим раком. На этот счет есть публикация, вышедшая пару дней назад - Why do patients with cancer die?.
И я мог бы просто кинуть вам на нее ссылку со словами “must read, срочно ознакомьтесь”, но…я был бы не автором “Очерков”, если бы просто ограничился ссылкой на статью, не представив свою адаптацию этого материала.
По ссылке ниже - ответы на простые, на первый взгляд, вопросы: почему конкретно гибнут пациенты с метастатическим раком и можно ли с этим что - то сделать? Ну и иллюстрация моего поиска ответа на вопрос “мог ли я что - то изменить?” Наверное, это один из самых важных и сложных для меня материалов, который я тут публикую. Так как я впервые для себя постараюсь осмыслить свои случаи, когда помочь пациентам так и не удалось. Поехали.
https://telegra.ph/Shit-happens-ili-esli-kakaya---to-katastrofa-mozhet-sluchitsya-s-onkologicheskim-pacientam---ona-kak-pravilo-sluchaetsya-06-20
#pathway #case
На первый взгляд, это невероятно простой вопрос, который не требует какого - либо ответа или пояснения.“Что тут вообще обсуждать??Есть рак, есть метастазы, чего ж вы ждете и хотите? Исход предрешен”, скажет еще кто - то, мол “все и так понятно”. Ну завидую гениям, кому все ясно в вопросах танатогенеза онкопациентов. Мне же не понятно еще очень многое.
Если углубиться в вопрос, как сделали Adrienne Boire и его коллеги, то можно разглядеть с десяток механизмов гибели наших пациентов с метастатическим раком. На этот счет есть публикация, вышедшая пару дней назад - Why do patients with cancer die?.
И я мог бы просто кинуть вам на нее ссылку со словами “must read, срочно ознакомьтесь”, но…я был бы не автором “Очерков”, если бы просто ограничился ссылкой на статью, не представив свою адаптацию этого материала.
По ссылке ниже - ответы на простые, на первый взгляд, вопросы: почему конкретно гибнут пациенты с метастатическим раком и можно ли с этим что - то сделать? Ну и иллюстрация моего поиска ответа на вопрос “мог ли я что - то изменить?” Наверное, это один из самых важных и сложных для меня материалов, который я тут публикую. Так как я впервые для себя постараюсь осмыслить свои случаи, когда помочь пациентам так и не удалось. Поехали.
https://telegra.ph/Shit-happens-ili-esli-kakaya---to-katastrofa-mozhet-sluchitsya-s-onkologicheskim-pacientam---ona-kak-pravilo-sluchaetsya-06-20
Nature
Why do patients with cancer die?
Nature Reviews Cancer - In this Roadmap, Boire et al. consider the immediate causes of mortality in patients with cancer, a topic not often considered in either preclinical or clinical research,...
🔥79❤27👍10👏4
Почему и как погибают онкологические пациенты, часть 2: попытка осмыслить патофизиологию печеночной недостаточности
#case #pathway
Мы продолжаем один из самых серьезных и сложных циклов статей на этом канале, и сегодняшняя часть будет посвящена разбору истории, которая оставила у меня весьма тяжелое впечатление. А также познакомила с явлением печеночной недостаточности у онкологических пациентов, обусловленной массивным метастатическим поражением.
Признаюсь честно, не нахожу поднятый вопрос идеально разобранным. Да и первая часть кажется мне куда более удачной.
Но, ознакомившись со второй частью, вы освежите в памяти нюансы патогенеза печеночной энцефалопатии, вспомните, какие еще проблемы поджидают пациентов с поражением печени...и возможно, узнаете в описанном кейсе кого - то из своих пациентов и поймете, что вы не одиноки в своем бессилии перед этой проблемой.
https://telegra.ph/Neprestupnyj-kolorektalnyj-rak-pechenochnaya-nedostatochnost-i-nesbyvshiesya-prognozy-06-22
#case #pathway
Мы продолжаем один из самых серьезных и сложных циклов статей на этом канале, и сегодняшняя часть будет посвящена разбору истории, которая оставила у меня весьма тяжелое впечатление. А также познакомила с явлением печеночной недостаточности у онкологических пациентов, обусловленной массивным метастатическим поражением.
Признаюсь честно, не нахожу поднятый вопрос идеально разобранным. Да и первая часть кажется мне куда более удачной.
Но, ознакомившись со второй частью, вы освежите в памяти нюансы патогенеза печеночной энцефалопатии, вспомните, какие еще проблемы поджидают пациентов с поражением печени...и возможно, узнаете в описанном кейсе кого - то из своих пациентов и поймете, что вы не одиноки в своем бессилии перед этой проблемой.
https://telegra.ph/Neprestupnyj-kolorektalnyj-rak-pechenochnaya-nedostatochnost-i-nesbyvshiesya-prognozy-06-22
Telegraph
Непреступный колоректальный рак, печеночная недостаточность и несбывшиеся прогнозы
Утро, август. Передо мной женщина лет сорока. Не могу сказать, что она выглядела здоровой, но на лице отражалась какая - то непоколебимая жизнерадостность и человеколюбие. Такого человека было невозможно заподозрить или представить в чем - то дурном, я уверен…
❤51🔥16👍5😢4
Человеку свойственно ошибаться и это заложено на генетическом уровне, часть 3: проблемы, связанные с дефектом BER
#colorectal #pathway
После долгой паузы от первого обсуждения биологии наследственных опухолевых заболеваний (напомню, что говорили мы об АРС - ассоциированных полипах) и еще более долгой паузы после обсуждения дефектов системы репарации в клетках, я возвращаю вас к проблеме наследственно - обусловленных полипозов - и предлагаю поговорить о достаточно редких вариантах полипозов.
Сегодня речь пойдет о случаях, при которых наследование риска патогенеза КРР наследуется аутосомно - рецессивно - главным образом, MUTYH - ассоциированный полипоз. Что такое MUTYH, почему поломка гена MUTYH приводит к раку толстой кишки (всегда ли?) и причем тут эксцизионная репарация оснований - по ссылке в короткой заметке.
https://telegra.ph/EHkscizionnaya-reparaciya-osnovanij-BER---Base-excision-repair---chto-ona-delaet-v-kletke-i-chto-mozhet-s-nej-sluchitsya-07-13
#colorectal #pathway
После долгой паузы от первого обсуждения биологии наследственных опухолевых заболеваний (напомню, что говорили мы об АРС - ассоциированных полипах) и еще более долгой паузы после обсуждения дефектов системы репарации в клетках, я возвращаю вас к проблеме наследственно - обусловленных полипозов - и предлагаю поговорить о достаточно редких вариантах полипозов.
Сегодня речь пойдет о случаях, при которых наследование риска патогенеза КРР наследуется аутосомно - рецессивно - главным образом, MUTYH - ассоциированный полипоз. Что такое MUTYH, почему поломка гена MUTYH приводит к раку толстой кишки (всегда ли?) и причем тут эксцизионная репарация оснований - по ссылке в короткой заметке.
https://telegra.ph/EHkscizionnaya-reparaciya-osnovanij-BER---Base-excision-repair---chto-ona-delaet-v-kletke-i-chto-mozhet-s-nej-sluchitsya-07-13
Telegraph
Эксцизионная репарация оснований (BER - Base excision repair) - что она делает в клетке и что может с ней случиться
Как вы помните, возникновение структурных дефектов в ДНК - явление, которое заложено в биологии наших клеток и в самом их появлении нет ничего сверхъестественного. Почему так происходит? Безусловно, несмотря на кажущуюся спонтанность развивающихся в ДНК дефектов…
🔥18❤4👍2
Гадание по анализам: может ли о чем то сказать D - димер?
#therapy #pathway
Только я поймал себя на мысли, что нет поводов для написания лонгридов, как жизнь подкидывает мне темы для размышлений сама. Недавно я столкнулся с последствиями применения антикоагулянтов, которые были назначены исходя из результатов анализа крови... на D - димер. И поскольку ситуации, где результаты лабораторных исследований порождают геморрой в нашей работе случаются не так уж редко, я решил всерьез задуматься о том, зачем вообще люди оценивают D - димер у онкологических пациентов и действительно ли это такая бесполезная штука?
Я предлагаю порассуждать вам со мной вместе на эту тему, высказать в комментариях, если вы в чем - то не согласны и желаю приятно провести время за чтением очередного очерка.
https://telegra.ph/Da-kto-ehtot-vash-D---dimer---i-o-chem-on-realno-mozhet-skazat-07-16
#therapy #pathway
Только я поймал себя на мысли, что нет поводов для написания лонгридов, как жизнь подкидывает мне темы для размышлений сама. Недавно я столкнулся с последствиями применения антикоагулянтов, которые были назначены исходя из результатов анализа крови... на D - димер. И поскольку ситуации, где результаты лабораторных исследований порождают геморрой в нашей работе случаются не так уж редко, я решил всерьез задуматься о том, зачем вообще люди оценивают D - димер у онкологических пациентов и действительно ли это такая бесполезная штука?
Я предлагаю порассуждать вам со мной вместе на эту тему, высказать в комментариях, если вы в чем - то не согласны и желаю приятно провести время за чтением очередного очерка.
https://telegra.ph/Da-kto-ehtot-vash-D---dimer---i-o-chem-on-realno-mozhet-skazat-07-16
👍34❤11🔥8👏3
Как может складываться судьба метастатического рака молочной железы - короткая заметка о мутационном ландшафте РМЖ с мутацией ESR1
#breast #pathway
Давненько тут не было духоты, по типу попыток рассмотреть молекулярно генетический ландшафт какой - нибудь рачины. А что можно обсуждать прям до бесконечности, как не рак молочной железы? Особенно люминальный рак молочной железы. Особенно если появляются новые данные, позволяющие взглянуть на это заболевание с немного новой стороны.
По ссылке - короткая заметка (с легким налетом кринжатины и размышлениями о том,каково было влияние российской науки на процесс изучения рака молочной железы в Европе) о том, как различается биология рака молочной железы в зависимости от мутационного статуса ESR1 и может ли это иметь для нас какое - нибудь значение.
Лонгрид, как по мне, не самый удачный, но не выкладывать жалко
https://telegra.ph/Kak-mozhet-skladyvatsya-sudba-metastaticheskogo-raka-molochnoj-zhelezy---korotkaya-zametka-o-mutacionnom-landshafte-RMZH-s-mutac-11-05
#breast #pathway
Давненько тут не было духоты, по типу попыток рассмотреть молекулярно генетический ландшафт какой - нибудь рачины. А что можно обсуждать прям до бесконечности, как не рак молочной железы? Особенно люминальный рак молочной железы. Особенно если появляются новые данные, позволяющие взглянуть на это заболевание с немного новой стороны.
По ссылке - короткая заметка (с легким налетом кринжатины и размышлениями о том,каково было влияние российской науки на процесс изучения рака молочной железы в Европе) о том, как различается биология рака молочной железы в зависимости от мутационного статуса ESR1 и может ли это иметь для нас какое - нибудь значение.
https://telegra.ph/Kak-mozhet-skladyvatsya-sudba-metastaticheskogo-raka-molochnoj-zhelezy---korotkaya-zametka-o-mutacionnom-landshafte-RMZH-s-mutac-11-05
Telegraph
Как может складываться судьба метастатического рака молочной железы - короткая заметка о мутационном ландшафте РМЖ с мутацией ESR1
Введение. В целесообразности применения гормонотерапии (плюс -минус таргетной терапии - CDK4/6 - ингибиторов, алпелисиба при PIK3CA - мутации и.т.д.) при метастатическом люминальном HER2 - негативном раке молочной железы настолько сложно усомниться в виду…
👍25❤13🔥7😁3🤮1
Что происходит с BRAFV600E мутированным КРР после прогрессирования: поданализ исследования BEACON
#pathway #colorectal
Энкорафениб + цетуксимаб (+- биниметиниб) в настоящее время - наиболее адекватный режим терапии предлеченного метастатического КРР с мутацией BRAF V600E. Как вы помните, эта группа пациентов сталкивается с крайне агрессивным течением КРР, крайне коварным поведением (даже при достигнутом ответе на терапию) и скромными ожидаемыми показателями общей выживаемости.
BEACON trial в 2019-21 гг стал своеобразным лучом света в этой кромешной тьме и подарил миру хоть какое - то вменяемое решение, продемонстрировав, что комбинация анти EGFR и анти BRAF (+-MEK) терапии - куда более вменяемая опция, чем иринотекан - содержащая химиотерапия, подробнее я разбирал это вот тут (заодно тут написано, зачем тут цетуксимаб)
Однако, медианы выживаемости все равно грустные, что побудило исследователей заняться "поисковым" анализом и оценить молекулярно - генетический ландшафт опухолевых образцов пациентов, участвовавших в исследовании.
Сам текст этого анализа вот здесь. Я для себя выделил несколько значимых (с точки зрения потенциального применения в работе и в разрезе перспективы дальнейших исследований) моментов:
Момент первый. Популяция пациентов крайне гетерогенная с точки зрения молекулярного ландшафта их опухоли: сигнатуры CMS1 и CMS4 (что это - см. тут), BM1 и BM2 (сам узнал о таком разделении буквально сейчас) - но все это не давало никаких различий в эффективности анти BRAF - EGFR - терапии. Тот случай, когда я могу сказать "да похер мне на эти ваши молекулярные подтипы, какая разница вообще"
Можно было бы еще пересказать вам данные подгруппового анализа - но ссылаться на него при принятии терапевтических решений (еще и в рамках ретроспективной работы) - вообще неблагодарное решение.
Момент второй. Куда интереснее тут взглянуть на механизмы резистентности к анти BRAF - EGFR - терапии,т.к. это может (хотя бы в теории) дать повод для попыток таргетной терапии в поздних линиях.
Хотя, казалось бы, зачем вообще искать мишени для таргетной терапии, когда есть универсальное решение в виде регорафениба??
Как такового ведущего механизма резистентности, потенциально развязывающего руки в отношении попытки таргетной терапии (по решению ВК в ЦАОП по месту жительства, естественно) особо и не вырисовывается, за исключением:
—амплификации гена MET, которая встречалась в 17 - 19% случаев, что, на мой взгляд, достаточно часто. Вроде как и потенциальная мишень, но живут такие пациенты меньше: OS: HR, 2.43 (95% CI, 1.616–3.650). Уместны ли тут препараты с активностью в отношении МЕТ? (например, кабозантиниб?) Вопрос, как минимум, заслуживающий изучения (хотя ставлю на то, что эффект будет на уровне регорафениба)
Напомню, что характер поломки гена может влиять на эффективность тирозинкиназных ингибиторов.
—другими, более менее стереотипными вариантами резистентности, были поломки (чаще всего в виде амплификации) генов KRAS, NRAS, MAP2K1(MEK1) - 8,9%,5,4% и 4,5 % случаев соответственно;
— были единичные эпизоды слияний (fusion) с участием генов BRAF (3,5%), MET (4,1%) и даже ALK (2,2%).
Как использовать эти данные? Да в целом, никак
Стало ли яснее, как именно прогрессирует часть пациентов? Да. Стало ли яснее, что с ними делать? Нет.
Стало ли понятнее, что с пациентами делать не стоит? Думаю, тоже да - я, скорее всего, воздержался бы от предложения выполнить NGS опухолевого материала - шансы найти что - то таргетируемое, не такие уж и большие .В лучшем случае, я бы обсуждал целесообразность прицельной оценки поломок гена MET, т.к. все остальное кажется совершенно беспонтовым. Хотя и амплификация МЕТ не гарантирует получения того же кабозантиниба по месту жительства...Да и какой - то эффект от него, собственно, тоже.
На этом все, я еще вернусь с очередными беспонтовыми размышлениями
#pathway #colorectal
Энкорафениб + цетуксимаб (+- биниметиниб) в настоящее время - наиболее адекватный режим терапии предлеченного метастатического КРР с мутацией BRAF V600E. Как вы помните, эта группа пациентов сталкивается с крайне агрессивным течением КРР, крайне коварным поведением (даже при достигнутом ответе на терапию) и скромными ожидаемыми показателями общей выживаемости.
BEACON trial в 2019-21 гг стал своеобразным лучом света в этой кромешной тьме и подарил миру хоть какое - то вменяемое решение, продемонстрировав, что комбинация анти EGFR и анти BRAF (+-MEK) терапии - куда более вменяемая опция, чем иринотекан - содержащая химиотерапия, подробнее я разбирал это вот тут (заодно тут написано, зачем тут цетуксимаб)
Однако, медианы выживаемости все равно грустные, что побудило исследователей заняться "поисковым" анализом и оценить молекулярно - генетический ландшафт опухолевых образцов пациентов, участвовавших в исследовании.
Сам текст этого анализа вот здесь. Я для себя выделил несколько значимых (с точки зрения потенциального применения в работе и в разрезе перспективы дальнейших исследований) моментов:
Момент первый. Популяция пациентов крайне гетерогенная с точки зрения молекулярного ландшафта их опухоли: сигнатуры CMS1 и CMS4 (что это - см. тут), BM1 и BM2 (сам узнал о таком разделении буквально сейчас) - но все это не давало никаких различий в эффективности анти BRAF - EGFR - терапии. Тот случай, когда я могу сказать
Можно было бы еще пересказать вам данные подгруппового анализа - но ссылаться на него при принятии терапевтических решений (еще и в рамках ретроспективной работы) - вообще неблагодарное решение.
Момент второй. Куда интереснее тут взглянуть на механизмы резистентности к анти BRAF - EGFR - терапии,т.к. это может (хотя бы в теории) дать повод для попыток таргетной терапии в поздних линиях.
Хотя, казалось бы, зачем вообще искать мишени для таргетной терапии, когда есть универсальное решение в виде регорафениба??
Как такового ведущего механизма резистентности, потенциально развязывающего руки в отношении попытки таргетной терапии (по решению ВК в ЦАОП по месту жительства, естественно) особо и не вырисовывается, за исключением:
—амплификации гена MET, которая встречалась в 17 - 19% случаев, что, на мой взгляд, достаточно часто. Вроде как и потенциальная мишень, но живут такие пациенты меньше: OS: HR, 2.43 (95% CI, 1.616–3.650). Уместны ли тут препараты с активностью в отношении МЕТ? (например, кабозантиниб?) Вопрос, как минимум, заслуживающий изучения (хотя ставлю на то, что эффект будет на уровне регорафениба)
Напомню, что характер поломки гена может влиять на эффективность тирозинкиназных ингибиторов.
—другими, более менее стереотипными вариантами резистентности, были поломки (чаще всего в виде амплификации) генов KRAS, NRAS, MAP2K1(MEK1) - 8,9%,5,4% и 4,5 % случаев соответственно;
— были единичные эпизоды слияний (fusion) с участием генов BRAF (3,5%), MET (4,1%) и даже ALK (2,2%).
Как использовать эти данные? Да в целом, никак
Стало ли яснее, как именно прогрессирует часть пациентов? Да. Стало ли яснее, что с ними делать? Нет.
Стало ли понятнее, что с пациентами делать не стоит? Думаю, тоже да - я, скорее всего, воздержался бы от предложения выполнить NGS опухолевого материала - шансы найти что - то таргетируемое, не такие уж и большие .В лучшем случае, я бы обсуждал целесообразность прицельной оценки поломок гена MET, т.к. все остальное кажется совершенно беспонтовым. Хотя и амплификация МЕТ не гарантирует получения того же кабозантиниба по месту жительства...Да и какой - то эффект от него, собственно, тоже.
На этом все, я еще вернусь с очередными беспонтовыми размышлениями
❤24👍5🔥1
Предсказываем судьбу по результатам NGS: новые данные о природе различий эффективности противоопухолевой терапии в зависимости от мутационного ландшафта
#pathway #article
Скрипя костями и всем, что от меня осталось после бурного празднования новогодних праздников, попробую вернуться хоть к какому бы то ни было темпу публикаций. Тем более, есть интереснейший повод - новые данные о предиктивном значении отдельных мутаций в отношении лекарственной терапии при различных видах ЗНО. Речь о статье Characterizing mutation-treatment effects using clinico-genomics data of 78,287 patients with 20 types of cancers, новость о которой я подглядел у коллег, которые включились в работу сильно раньше, чем я:)
По ссылке вы найдете краткий разбор сути и результатов работы, попытку осмысления причин получившихся результатов и размышления о том, почему подобные работы стоят нашего внимания. Поехали.
https://telegra.ph/Predskazyvaem-po-rezultatam-NGS-novye-dannye-o-prirode-razlichij-ehffektivnosti-protivoopuholevoj-terapii-v-zavisimosti-ot-mutac-01-04
#pathway #article
Скрипя костями и всем, что от меня осталось после бурного празднования новогодних праздников, попробую вернуться хоть к какому бы то ни было темпу публикаций. Тем более, есть интереснейший повод - новые данные о предиктивном значении отдельных мутаций в отношении лекарственной терапии при различных видах ЗНО. Речь о статье Characterizing mutation-treatment effects using clinico-genomics data of 78,287 patients with 20 types of cancers, новость о которой я подглядел у коллег, которые включились в работу сильно раньше, чем я:)
По ссылке вы найдете краткий разбор сути и результатов работы, попытку осмысления причин получившихся результатов и размышления о том, почему подобные работы стоят нашего внимания. Поехали.
https://telegra.ph/Predskazyvaem-po-rezultatam-NGS-novye-dannye-o-prirode-razlichij-ehffektivnosti-protivoopuholevoj-terapii-v-zavisimosti-ot-mutac-01-04
Telegraph
Предсказываем по результатам NGS: новые данные о природе различий эффективности противоопухолевой терапии в зависимости от мутационного…
Преамбула. У меня достаточно рано и быстро нашелся ответ на вопрос, почему мы можем вылечить - или корректнее сказать, добиться ремиссии длинною в жизнь или хотя бы на какой - то вменяемый срок - у многих наших пациентов. Однако, с самого начала своего погружения…
🔥30❤7👍3😢1
Сложная судьба CDK4/6- ингибиторов при BRCA - мутации: что влияет на их эффективность при BRCA - мутации и что делать с этой информацией
#breast #pathway
Негативные предикторы эффективности CDK4/6 - ингибиторов - вопрос, который пока далек от своего окончательного решения и вопрос, который продолжает изучаться и пополняться новыми данными. Многое по этой проблеме еще окончательно непонятно; однако, доподлинно известно о негативном влиянии поломок генов BRCA на эффективность терапии CDK4/6 - ингибиторами, о чем свидетельствует пул данных из поданализов РКИ и RWE - исследований
У меня, собственно, как обычно возникает вопрос: как и почему так получается? Неужто поломка BRCA 1 или 2 предрасполагает к тому, что биология люминального рака молочной железы при наличии этой поломки сворачивается к направлению более раннего развития эндокринной резистентности? Что известно сегодня и что делать с этой информацией? Об этом сегодняшняя короткая заметка
https://telegra.ph/Nekotorye-soobrazheniya-otnositelno-prirody-menshej-ehffektivnosti-CDK46--ingibitorov-pri-BRCA---mutacii-i-o-tom-chto-delat-s-eh-03-02
#breast #pathway
Негативные предикторы эффективности CDK4/6 - ингибиторов - вопрос, который пока далек от своего окончательного решения и вопрос, который продолжает изучаться и пополняться новыми данными. Многое по этой проблеме еще окончательно непонятно; однако, доподлинно известно о негативном влиянии поломок генов BRCA на эффективность терапии CDK4/6 - ингибиторами, о чем свидетельствует пул данных из поданализов РКИ и RWE - исследований
У меня, собственно, как обычно возникает вопрос: как и почему так получается? Неужто поломка BRCA 1 или 2 предрасполагает к тому, что биология люминального рака молочной железы при наличии этой поломки сворачивается к направлению более раннего развития эндокринной резистентности? Что известно сегодня и что делать с этой информацией? Об этом сегодняшняя короткая заметка
https://telegra.ph/Nekotorye-soobrazheniya-otnositelno-prirody-menshej-ehffektivnosti-CDK46--ingibitorov-pri-BRCA---mutacii-i-o-tom-chto-delat-s-eh-03-02
Telegraph
Некоторые соображения относительно природы меньшей эффективности CDK4/6- ингибиторов при BRCA - мутации и о том, что делать с этой…
Тут уместно предварительно перенаправить читателя к более раннему материалу, который посвящен обсуждению того, почему CDK4/6- ингибиторы перестают работать у пациенток с HR+HER2- раком молочной железы https://telegra.ph/Molekulyarno---geneticheskie-aspekty…
👍20👏6❤5
Новые данные о молекулярном портрете НМРЛ при поражении ЦНС
#lung #pathway
Помню, давным - давно я грузил вас описаниями молекулярной гетерогенности аденокарциномы легкого и тем, как эта гетерогенность определяет метастатическое поведение опухолины, Сегодня у меня для вас есть новые данные, проливающие немного света на то, каким может быть биология НМРЛ при поражении ЦНС (весьма частый сценарий течения этого заболевания, к сожалению).
При поражении ЦНС, обусловленного прогрессированием НМРЛ, мы обычно не ждем многого от иммунотерапии чек - поинт ингибиторами, несмотря на - честно сказать - не самые паршивые данные об ожидаемой частоте объективного ответа около 30% (поданализ KEYNOTE-ов, данные 2 фазы). И, возможно напрасно, т.к. в ряде случаев микроокружение опухолевых очагов в ЦНС характеризуется меньшей иммуногенностью, чем можно было бы ожидать.
Об этом свидетельствуют свежайшие данные группы несчастных аспирантов из Мадисона (Manlu Liu et al), отсеквенировавших опухолевые образцы 3060 пациентов с НМРЛ и проанализировавших, чем биология опухолевых очагов в ЦНС отличается от первичной опухоли. А также то, какими в принципе по своему молекулярному ландшафту могут быть очаги в ЦНС. Что они там получили?:
— наиболее частыми поломками при поражении ЦНС были поломки гена tp53 (77%), KRAS (43%), CDKN2A (37%) и EGFR (17%). Что в контексте более старых данных не то, чтобы сильно удивительно, да и практической значимости пока я тут выделить никакой не могу.
— мутационная нагрузка в очагах в ЦНС, в целом, была выше, что я усматриваю следствием поломки tp53. Однако, на эффективность иммунотерапии уровень TMB, по данным обсуждаемой работы,влиял...примерно никак. Что тоже не удивительно
— в целом, очаги ЦНС, в сравнении с первичной опухолиной легкого и другими сайтами метастазирования, характеризовались меньшей экспрессией PD -L1, более высокой мутационной нагрузкой, но...более частой встречаемостью ISR - high ( 56.8%) - штуки, которая ранее показала определенную предиктивную ценность в отношении прогнозирования ответа на пембролизумаб (правда, на сравнительно ничтожном количестве пациентов ~189).
— примечательно, что очаги в ЦНС демонстрировали несколько разный профиль экспрессии генов, непосредственно вовлеченных в реализацию иммунного ответ на основании которой все случае поражения ЦНС исследователи условно поделили на immune - enriched и non - enriched группы (список генов на слайдах). И у 36 человек (очень немного, но тем не менее), получавших иммунотерапию, получилось оценить 2 - х летнюю выживаемость, различавшуюся в зависимости от принадлежности конкретного очага в иммуно-обогащенную или необогащенную когорту: 74,1% против 48,5% в пользу immune - enriched.
Какие умозаключения можно вынести?
— интересно, что эффект иммунотерапии может быть детерминирован не мутационной нагрузкой и не столько уровнем экспрессией PD - L1 в опухоли .сколько паттерном экспрессии генов, вовлеченных в иммунный ответ, в целом. И это очередное свидетельство того, что нам нужно искать новые предикторы ответа на иммунотерапию, где - то вот в плоскости комплексной оценки того, что там экспрессирует опухоль
— принимать решения на основании данных выживаемости 36 человек, естественно, тупо и никому я так делать не советую. Значение этой работы больше в том, что она немного проливает свет на природу неожиданно длительного и позитивного ответа, который иной раз можно увидеть у пациентов на иммунотерапию при прогрессирующем НМРЛ (при котором не все пациенты, по разным причинам, получают иммунку в первой линии)
— много мутаций еще не равно большая иммуногенность, что мы, собственно, в очередной раз и увидели
#lung #pathway
Помню, давным - давно я грузил вас описаниями молекулярной гетерогенности аденокарциномы легкого и тем, как эта гетерогенность определяет метастатическое поведение опухолины, Сегодня у меня для вас есть новые данные, проливающие немного света на то, каким может быть биология НМРЛ при поражении ЦНС (весьма частый сценарий течения этого заболевания, к сожалению).
При поражении ЦНС, обусловленного прогрессированием НМРЛ, мы обычно не ждем многого от иммунотерапии чек - поинт ингибиторами, несмотря на - честно сказать - не самые паршивые данные об ожидаемой частоте объективного ответа около 30% (поданализ KEYNOTE-ов, данные 2 фазы). И, возможно напрасно, т.к. в ряде случаев микроокружение опухолевых очагов в ЦНС характеризуется меньшей иммуногенностью, чем можно было бы ожидать.
Об этом свидетельствуют свежайшие данные группы несчастных аспирантов из Мадисона (Manlu Liu et al), отсеквенировавших опухолевые образцы 3060 пациентов с НМРЛ и проанализировавших, чем биология опухолевых очагов в ЦНС отличается от первичной опухоли. А также то, какими в принципе по своему молекулярному ландшафту могут быть очаги в ЦНС. Что они там получили?:
— наиболее частыми поломками при поражении ЦНС были поломки гена tp53 (77%), KRAS (43%), CDKN2A (37%) и EGFR (17%). Что в контексте более старых данных не то, чтобы сильно удивительно, да и практической значимости пока я тут выделить никакой не могу.
— мутационная нагрузка в очагах в ЦНС, в целом, была выше, что я усматриваю следствием поломки tp53. Однако, на эффективность иммунотерапии уровень TMB, по данным обсуждаемой работы,влиял...примерно никак. Что тоже не удивительно
— в целом, очаги ЦНС, в сравнении с первичной опухолиной легкого и другими сайтами метастазирования, характеризовались меньшей экспрессией PD -L1, более высокой мутационной нагрузкой, но...более частой встречаемостью ISR - high ( 56.8%) - штуки, которая ранее показала определенную предиктивную ценность в отношении прогнозирования ответа на пембролизумаб (правда, на сравнительно ничтожном количестве пациентов ~189).
— примечательно, что очаги в ЦНС демонстрировали несколько разный профиль экспрессии генов, непосредственно вовлеченных в реализацию иммунного ответ на основании которой все случае поражения ЦНС исследователи условно поделили на immune - enriched и non - enriched группы (список генов на слайдах). И у 36 человек (очень немного, но тем не менее), получавших иммунотерапию, получилось оценить 2 - х летнюю выживаемость, различавшуюся в зависимости от принадлежности конкретного очага в иммуно-обогащенную или необогащенную когорту: 74,1% против 48,5% в пользу immune - enriched.
Какие умозаключения можно вынести?
— интересно, что эффект иммунотерапии может быть детерминирован не мутационной нагрузкой и не столько уровнем экспрессией PD - L1 в опухоли .сколько паттерном экспрессии генов, вовлеченных в иммунный ответ, в целом. И это очередное свидетельство того, что нам нужно искать новые предикторы ответа на иммунотерапию, где - то вот в плоскости комплексной оценки того, что там экспрессирует опухоль
— принимать решения на основании данных выживаемости 36 человек, естественно, тупо и никому я так делать не советую. Значение этой работы больше в том, что она немного проливает свет на природу неожиданно длительного и позитивного ответа, который иной раз можно увидеть у пациентов на иммунотерапию при прогрессирующем НМРЛ (при котором не все пациенты, по разным причинам, получают иммунку в первой линии)
— много мутаций еще не равно большая иммуногенность, что мы, собственно, в очередной раз и увидели
❤9👍7